
新冠疫情期间,我几乎休了有史以来最大的一个假,期间看了一些以前一直想看,又没机会看的书,也参与了一些公益咨询答疑活动。离患者的距离越近,就越能体会患者的很多焦虑、无助的心情,有时候也能听到很多患者及家属怨天尤人,自暴自弃的话,说实在的,作为一名医生,心里很不是滋味。
1938年,毛主席在抗日战争最困难的时刻,曾经写下过载入史册的《论持久战》,在文中,他尤其驳斥了“亡国论”和“速胜论”,指出了既不能丧失信心放弃抵抗,也不能盲目乐观麻痹大意,要树立和坚持“持久作战”的信念。这一论断,坚定了全党全军和人民群众团结一致抗日的决心,精准的预测了战争的走向与结局。
再读此文,联想到我们的神经肿瘤患者,尤其是脑胶质瘤患者,与疾病抗争的过程也像是一场艰苦卓绝的战争。那么究竟如何正确面对这一场命运之战?
很多人闻之色变,很多人避之不谈,这都不是正确的态度。在本文中,我将针对一些患者和家属十分关心的问题,谈谈我对精准医疗在神经肿瘤特别是脑胶质瘤中的应用。
1. 什么是精准医疗?对患者意味着什么?
精准医疗是指医生根据对疾病在基因层面的了解,选择最可能帮助患者的治疗方法,也被称为个性化医疗。精准医疗的概念并不新鲜,但最近科技进展加速了这一领域的突破。用通俗话的说,精准医疗的方法让患者对自己的肿瘤有了“高清无码”的认识。
为什么精准医疗这么重要呢?因为肿瘤即使病理类型、级别都完全相同,在基因层面也可能完全不同。在大约10年前,我刚参加工作那会儿,同类型、同阶段的肿瘤患者接受的治疗都是一样的,最大程度手术、放疗、化疗等。但医生观察到一个奇怪的现象:肿瘤的类型、阶段都一样的患者,对于同样的治疗,会有完全不同的反应。当时,医生还不知道原因,只能用“个体差异”来进行解释。
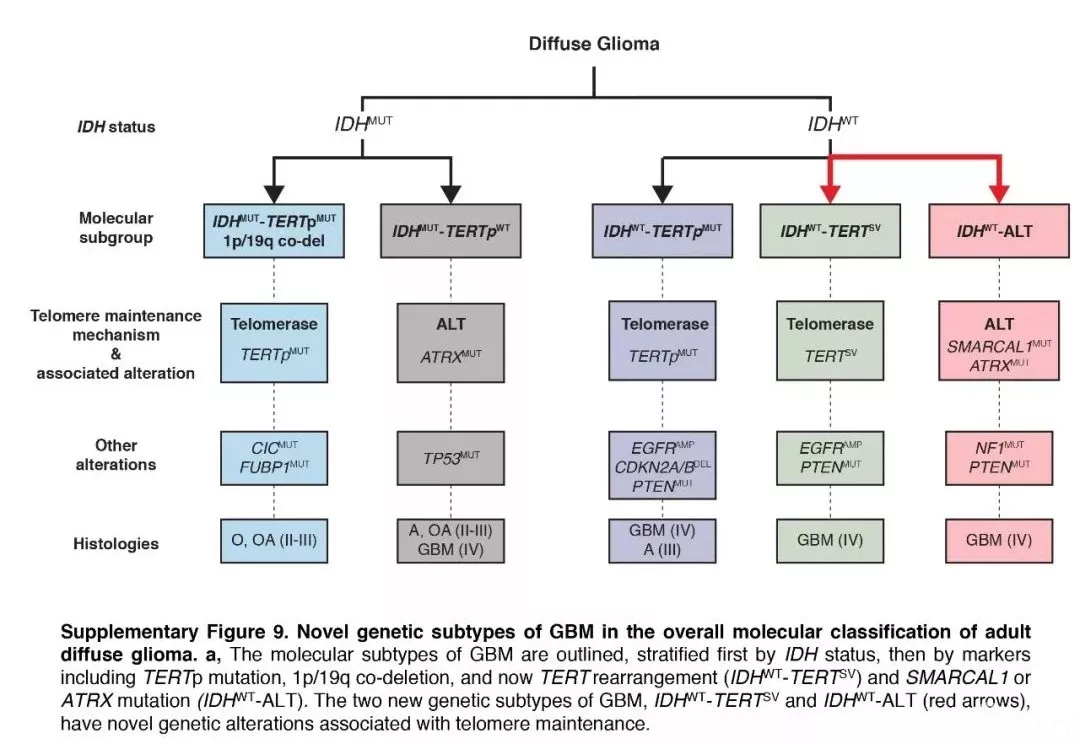
直到最近,在基因组学的蓬勃发展下,科学家们现在明白了患者的肿瘤的生长和扩散都是由对应的基因变化所驱动的。他们还了解到,同一类肿瘤可能基因变化并不相同,而不同类型的肿瘤却也可能存在同样的基因变化。就胶质瘤而言,因为驱动基因的不同,胶质母细胞瘤可以分为多种截然不同的分子亚型,并且可能存在相互转化。这些亚型对于常规治疗的敏感性、患者生存时间都不尽相同。
这些特定的基因变化、信号通路的激活,有可能是未来治疗的靶点。
对患者而言,针对肿瘤做深度基因检测,至少可以获得以下几个好处:
(1). 对于疾病的亚型、驱动基因、疾病预后有初步认识;
(2). 对于替莫唑胺后续化疗的敏感性、获益程度有预判;
(3). 对于突变、融合、缺失的基因位点有清晰的认识,为未来匹配靶向治疗药物、免疫治疗和临床研究进行准备。
这一观点,已经获得了国内外神经外科/神经肿瘤科医生的普遍共识(“引用《深度分子检测应当成为脑肿瘤的诊治常规》”)。
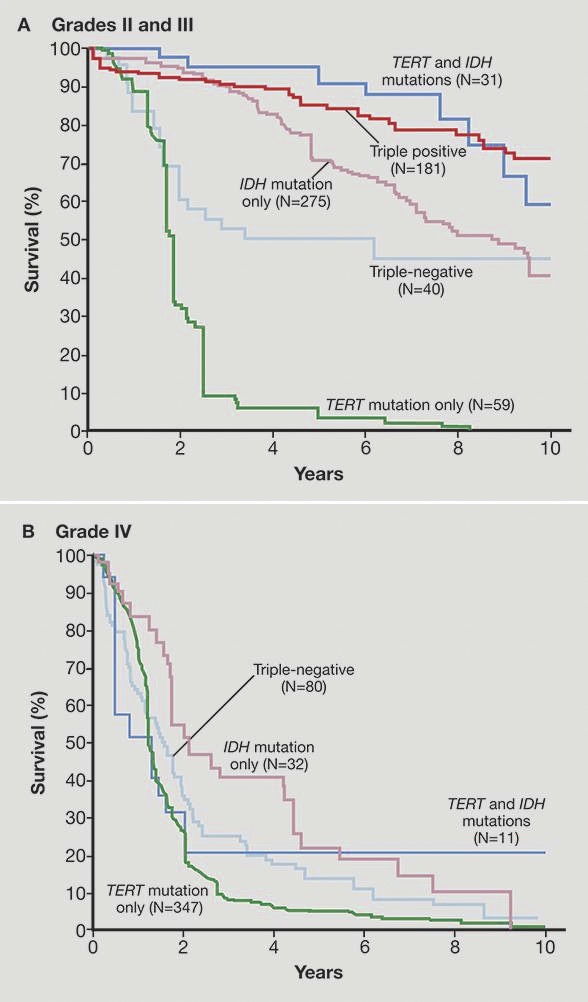
本图是美国Mayo Clinic神经外科团队发表在《新英格兰医学杂志》的文章截图,显示了不同的分子特点,与不同级别胶质瘤的预后生存期密切相。(New England Journal of Medicine. 2015;372:2499.)
2. 那肿瘤治疗直接针对异常靶点开炮就行了呗?
这确实是过去10多年针对肿瘤靶向治疗的普遍思路,在肺癌、乳腺癌、血液系统肿瘤中尤为典型,已经形成了“根据不同基因型选择起始治疗方案,根据耐药反应动态调整靶向药物”的序贯治疗方案。
但是,对中枢神经系统的胶质瘤而言,并没有这么简单。
首先,胶质瘤化疗的一线用药,目前只有替莫唑胺这一个药物。因此,在起始治疗方案的选择上,无论患者的基因型是什么,都首先应当接受标准的Stupp方案治疗,即以替莫唑胺为基础的同步放化疗+辅助化疗。这也是作为临床医生特别想强调的一句话:精准治疗的基础首先是标准治疗,个体化靶向治疗是后续考虑的非常规武器。
最早批准并获NCCN指南唯一承认的靶向药物是贝伐珠单抗–即VEGF血管内皮生长因子抗体。此外,还有VEGFR酪氨酸激酶抑制剂(以阿帕替尼、瑞戈非尼为代表)、EGFR酪氨酸激酶抑制剂或单克隆抗体(尼妥珠单抗、奥西替尼等)、小分子多靶点酪氨酸激酶抑制剂(安罗替尼)、Braf-V600E抑制剂(维莫非尼)等许多药物正在进行临床探索和研究,但都还没有成为标准治疗方案写进指南。
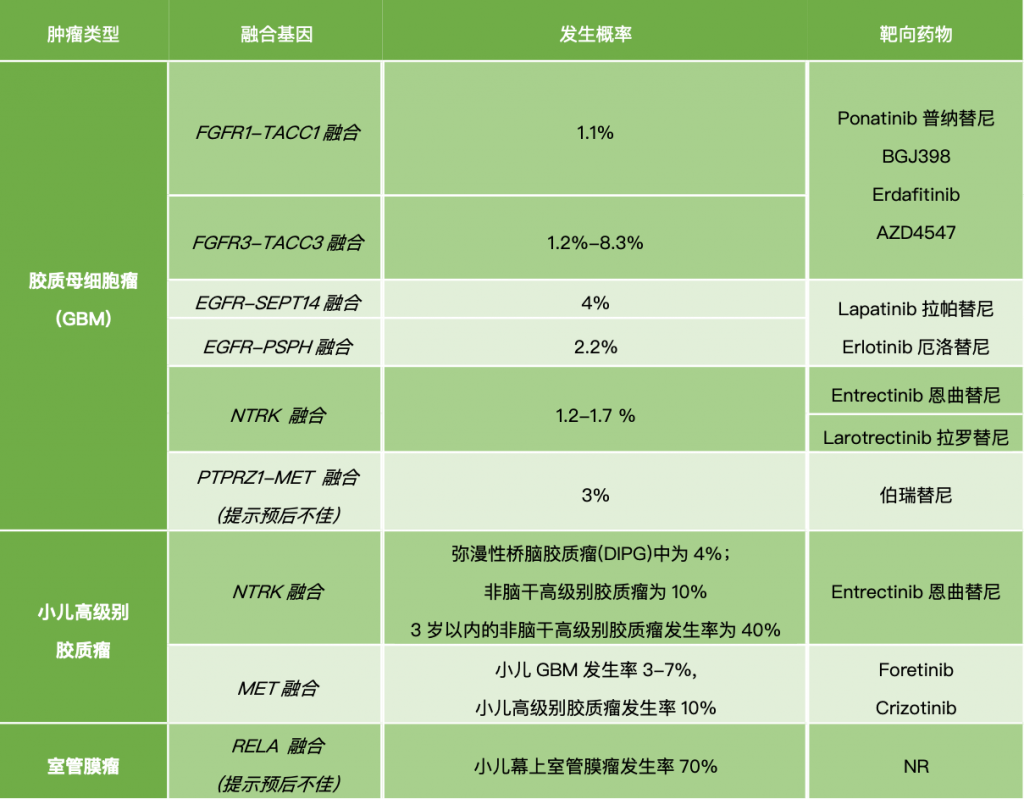
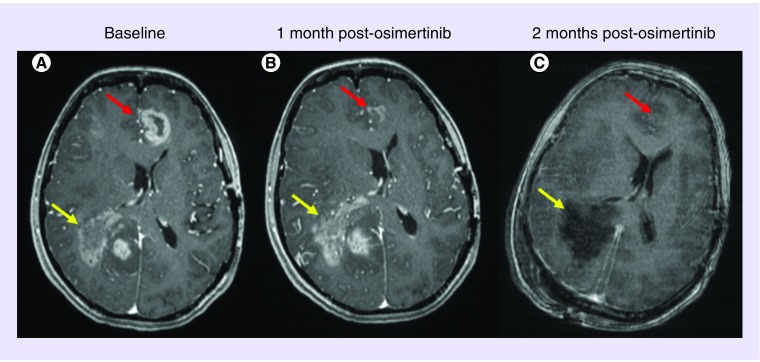
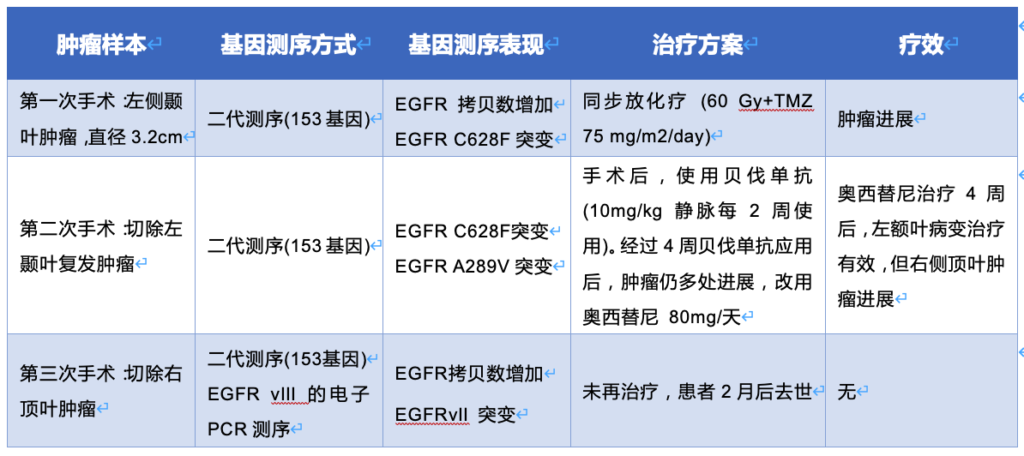
在已经报道的研究数据中,靶向治疗还是在胶质瘤患者群体中取得了很有意义的治疗结果,虽然并不能够改变最终的结局,但是确实延长了生命,提高了生活质量。不少使用贝伐单抗治疗的复发胶质瘤患者生存期超过了3年(https://drxutao.com/?p=567),一例存在EGFR C628F和A289V两个突变位点的复发GBM患者,应用奥西替尼(泰瑞沙)后,病灶几乎完全减退( https://drxutao.com/?p=618)。去年,靶向NRTK融合基因的药物曾经因为显著的临床效果火了好一阵子,在一项临床研究(NCT02568267)中,一名携带BCAN-NTRK1融合的桥脑星形细胞瘤患者,使用Entrectinib后,肿瘤体积缩小了45%。另一项临床研究(NCT02576431)则发现:一名35岁,颅内多发GBM的女性患者,检测出EML4-NTRK3融合,给予Larotrectinib治疗后,脑室旁的肿瘤体积显著减小(从67x52mm到8x4mm)。这些结果,都给临床医生和患者带来了新的希望。
但是胶质瘤的发生与发展,是由多个基因驱动的,单纯针对一个异常靶点进行治疗,效果有限且容易造成耐药,因此需要定期监测复查,及时调整药物。
3. 精准医疗应用胶质瘤治疗中所存在的问题:
虽然前面说到的现状看起来十分美好,但精准医疗在脑胶质瘤中的应用仍存在很多问题,亟待解决。这些问题可以用八个字来形容:“乘兴而至、败兴而归。”也就是:患者花了钱,医生费了心,但是却没有找到有治疗意义的结果。这是由多种因素多造成的:
(1). 目前可以作为药物靶点的基因位点,只有400多个,而人类的全基因组有两万多条基因,在编码基因的区块之间还包含了大量非编码基因区域。因此,筛选到的异常表达靶点,很有可能没有对应的靶向药物。而对神经肿瘤而言,由于“血脑屏障”的存在,即使有靶向药物,也可能无法进入颅内起到杀灭肿瘤的效果。
(2). 很多有意义的异常靶点,它的突变频率非常低,也就意味着,大规模的筛检很可能是一种“大海捞针”的行为,对少部分的幸运儿有意义,而对绝大多数患者,则没有明显意义。比如上面所提到的NRTK融合基因,虽然治疗效果显著,但它在成人胶质母细胞瘤中的突变频率仅1.2-1.7%,因此,如何避免“撒大网、捞小虾”这样的情况,仍需要不断思考。
2019年,瑞典卡罗林斯卡研究所的研究人员在国际期刊《Nature Communications》上发表了最新研究成果,他们开发出一种新型的廉价检测肿瘤技术,该技术可以基于微量组织样本进行检测,并且能够识别出具有高度异质性和较强侵袭性的肿瘤样本,这项基于高效微量的基因检测技术有望使保质保量的低价肿瘤检测成为现实。
(3). 患者仍然需要更多基于个人测序报告的深度解读和治疗建议。目前,绝大多数基于突变位点的治疗药物都属于经验性/试验性用药,并非指南推荐的一线用药,无论是治疗方案的敲定、配药、随访等等各个环节,都需要医患之间深入的频繁沟通,以及患者的高度信任与配合。同时,有必要在医院/检测机构建立数据库,当有新靶向药物获得突破时,能够有人及时告知曾经做过基因测序,且存在相应突变靶点的患者。这样,才能够让患者的测序达到最大的效能。
4. 精准医学未来发展的展望
(1). 治疗完全精准化。
精准医学的希望是,有朝一日,治疗方法将根据每个人的癌症基因变化量身定制,使患者不至于接受无济于事的治疗。同时,患者的基因检测数据将有专门的人员进行管理与追踪,定期将最新的治疗进展与可选方案提供给患者。
(2). 更多支付手段助力患者完成付费。
目前基因测序的费用仍然需要自费完成,对患者而言,是颇为沉重的负担。尤其当检测的结果不尽如人意,未能寻找到有意义的治疗靶点时,家属往往会有些沮丧,觉得钱打了水漂。为了解决这个问题,美国已经开始尝试,将癌症基因检测纳入商业医保,而中国的“基因+保险”模式,也开始了探索。有公司推出针对肿瘤二代测序检测和指定保险用药目录结合的肿瘤商业保险,通过基因检测、临床诊疗和保险的深度整合,进一步推动精准医疗在中国的创新和发展。
(3). 在治疗全过程中多次测序。
首次测序一般是在初次诊断肿瘤时,但随着时间推移和放化疗等治疗过程,可能会出现额外的基因变化。因此如果肿瘤出现复发或恶化,理论上也应当进行检测,来寻找耐药机制,以及下一步治疗方案。
(4). 更多基于基因测序结果的临床研究。
尽管研究人员每天都在取得进展,但精准医学治疗癌症的方法还没有成为大多数患者常规治疗的一部分。目前,许多针对特定基因变化而设计的新疗法正在进行精准医学临床试验。这类精准医学临床试验的结果,有助于更好的评估靶向药物在胶质瘤治疗中的效果。
(5) 真实世界大数据的建立
科学研究仍然在不断向前发展,全世界的研究人员至今还没有发现所有能导致癌症发展、生长和扩散的基因变化。每天都会有大量新的发现。这些来自真实世界的研究信息被收集到数据库中,全球各地的研究人员可以在数据库中访问这些数据,并将其用于自己的研究。这种数据共享有助于推动精准医学领域的发展。同时,这一数据不仅仅可用于科研,也将应用于临床治疗,患者有望在数据库中看到和自己同样基因型的患者,采用不同治疗方案之后所取得的效果,作为制定自己治疗方案时的参考。
结语
“理性面对现实,和医生做充分而坦诚的沟通,相信科学,及时了解最新进展,做好持久作战的准备”,是我想送给每一位神经肿瘤患者和家属的话。
医生和患者、家属,是战友的关系。现在的科学技术当然还没有做到根治脑肿瘤的程度,但我们也不是像十几年前一样手无寸铁,赤手空拳了,我们也有了新式的武器。让我们一起向80多年前的前辈们学习,步步为营,节节抵抗,积小胜为大胜,以空间换时间,携手打好这一场持久战。
我们终将胜利。
参考文献:
- Diplas BH, et al. The genomic landscape of TERT promoter wildtype-IDH wildtype glioblastoma. Nat Commun. 2018 May 25;9(1):2087. doi: 10.1038/s41467-018-04448-6. (PMID:29802247)
- Liu LY, et al. Patterns of long-term survivorship following bevacizumab treatment for recurrent glioma: a case series. CNS Oncol. 2019 Jun 1;8(2):CNS35. doi: 10.2217/cns-2019-0007. Epub 2019 Jul 11.(PMID:31293169)
- Xu T, et al. Gene Fusion in Malignant Glioma: An Emerging Target for Next-Generation Personalized Treatment. Transl Oncol. 2018 Jun;11(3):609-618. doi: 10.1016/j.tranon.2018.02.020. Epub 2018 Mar 20. (PMID:29571074 )
- Makhlin I, et al. Clinical activity of the EGFR tyrosine kinase inhibitor osimertinib in EGFR-mutant glioblastoma. CNS Oncol. 2019 Nov 1;8(3):CNS43. doi: 10.2217/cns-2019-0014. Epub 2019 Nov 15.(PMID:31769726)
- Zhang X, et al. CUTseq is a versatile method for preparing multiplexed DNA sequencing libraries from low-inputsamples. Nat Commun. 2019 Oct 18;10(1):4732. doi: 10.1038/s41467-019-12570-2. (PMID:31628304)







近期评论