美国俄亥俄州立大学Wexner医学中心肿瘤内科的Mark Damante等人,进行的一项回顾性研究,旨在比较ICI与靶向药物治疗RCC脑转移患者的疗效,并评估早期接受ICI与靶向治疗的RCC患者进展为脑转移的风险。结果发表在2023年8月的《Neurosurg Focus》上。
——By 胡渝,周岱冉
【Ref:Damante M, et al. Neurosurg Focus. 2023 Aug 1; 55(2):E2. doi:10.3171/2023.5.FOCUS23122.】
研究背景
肾细胞癌(renal cell cancer, RCC)早期往往没有症状,难以发现。约30 %的患者被同步诊断为IV期RCC,其中转移到大脑的病例占4 % – 17 %。包括舒尼替尼和依维莫司在内的靶向药物使得晚期RCC的预后得到了改善。免疫检查点抑制剂(immune checkpoint inhibitor, ICI)也已被证明对晚期RCC的治疗有效,且可能比靶向药物更具优势。尽管ICI治疗无脑转移(brain metastases, BMs)的转移性RCC的疗效已在多个临床试验中得到证实,但未经治疗或有症状的BMs患者通常被排除在这些试验之外,且与靶向治疗的对照证据并不充分。因此,ICI治疗或预防BM的疗效尚不完全明确。美国俄亥俄州立大学Wexner医学中心肿瘤内科的Mark Damante等人,进行的一项回顾性研究,旨在比较ICI与靶向药物治疗RCC脑转移患者的疗效,并评估早期接受ICI与靶向治疗的RCC患者进展为脑转移的风险。结果发表在2023年8月的《Neurosurg Focus》上。
研究方法
回顾性分析2011年至2018年在美国俄亥俄州立大学Wexner医学中心接受系统治疗的425例RCC患者的临床资料。研究期间113例患者经MRI检查确诊为BMs。收集患者人口统计学、系统治疗、RCC诊断后生存期(overall survival from RCC diagnosis, OSRCC)和BM诊断后生存期(overall survival from BM diagnosis, OSBM)数据。对每位患者的系统治疗方案进行评价(图1)。根据是否在潜在颅内受累之前应用靶向治疗或ICI,对患者进行进一步的亚分类,以确定BM发生的概率。在脑转移瘤患者中评估其他关于实施颅内局部干预措施的细节,如立体定向放射外科(stereotactic radiosurgery, SRS)和/或神经外科干预,以评估其对预后的影响。
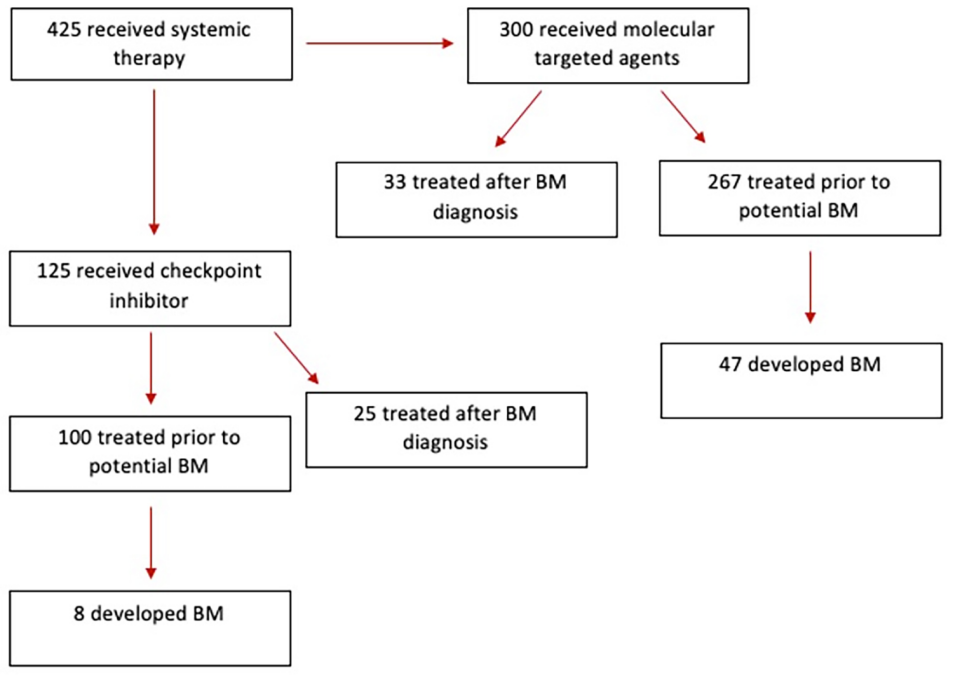
图1. 患者队列的治疗组细分。
研究结果
该研究包括425名诊断为RCC并接受靶向治疗和/或ICI治疗的患者。共有113例患者(9.5%)发生颅内转移。两个治疗组之间的患者性别、原发性癌症年龄和BM数量,诊断时BM的数量、疾病的幕上位置和最大肿瘤直径,无显著差异。两组的出血率和脊柱转移发生率相似。
接受全身性药物治疗的所有425例患者的OSRCC为56.2个月。在发生BM的113例患者中(不考虑治疗方案),中位OSRCC为32.1个月,1年、2年和5年生存率分别为78.6%、61.4%和36.1%。接受ICI治疗的BM患者(n = 33,29.2%)的中位OSRCC为77.2个月,1年、2年和5年生存率分别为93.9%、81.8%和62.6%。仅接受靶向治疗的患者的OSRCC为25.2个月,1年、2年和5年生存率分别为72.2%、52.8%和25.3%(n = 80,70.8%)。与接受单独分子靶向治疗的患者相比,接受ICI的患者的OSRCC显著延长。
113例诊断为BM的患者的OSBM为12.3个月。在接受ICI的患者中(n = 33),OSBM为21.7个月,1年、2年和5年生存率分别为69.7%、48.0%和27.2%。接受靶向治疗的患者(n = 80)的OSBM为8.9个月,1年、2年和5年生存率分别为42.5%、24.4%和10.4%。与单独的靶向疗法相比,在其病程期间使用ICI疗法与OSBM的显著增加相关。(图2)
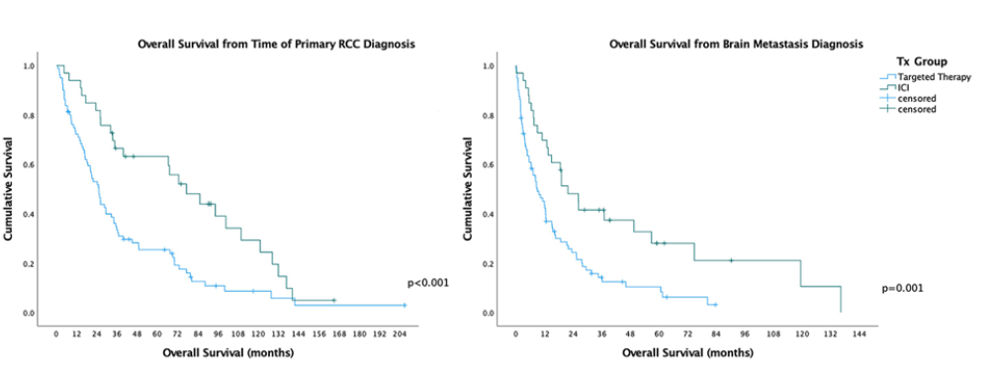
图2. 生存分析(Kaplan-Meier曲线,经log-rank检验)。左: 靶向与ICI治疗组OSRCC比较。右:靶向与ICI治疗组OSBM比较。
失访患者从分析中删除,并在曲线上打勾表示。
在用ICI治疗的BM患者(n = 33)中,选择的少数患者用组合的纳武单抗和伊匹单抗疗法治疗(n = 6,18.2%),而其余患者接受单一疗法纳武单抗(n = 27,81.8%)。与单药ICI相比,联合ICI治疗有OSBM增加的趋势,尽管差异无统计学显著性。
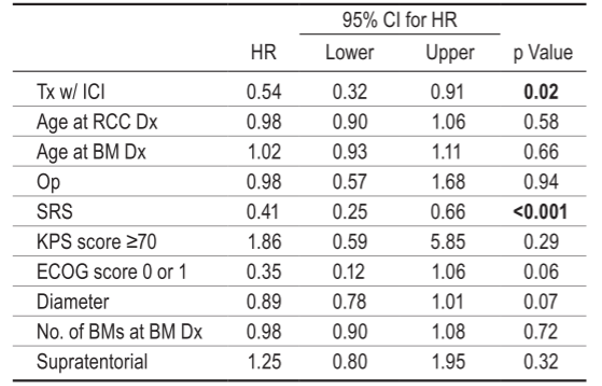
通过多变量考克斯回归分析评估可能影响BM患者OSBM的协变量。RCC和BM诊断时的年龄、诊断时BM的数量、疾病的幕上位置和良好的体能状态评分(KPS评分≥ 70和ECOG评分0或1)对OSBM无显著影响。BM切除对OSBM无显著影响(HR 0.98,95% CI 0.57-1.68; p = 0.94),而SRS与OSBM改善相关(HR 0.41,95%CI 0.25-0.66; p < 0.001)。(表1)
表1. 113例脑转移患者OSBM的Cox回归分析
-
加粗字体表示有统计学意义。
425例患者中有367例(86.4%)在潜在颅内受累之前开始全身治疗。在接受ICI治疗的100名患者中,有8%的人会继续发展BM,而在接受单独靶向治疗的267名患者中,这一比例为17.6%。接受ICI的患者的OR(OR 0.41,95% CI 0.18-0.89; p = 0.021)表明与仅接受靶向治疗的患者相比,颅内受累的可能性较低(图3)。
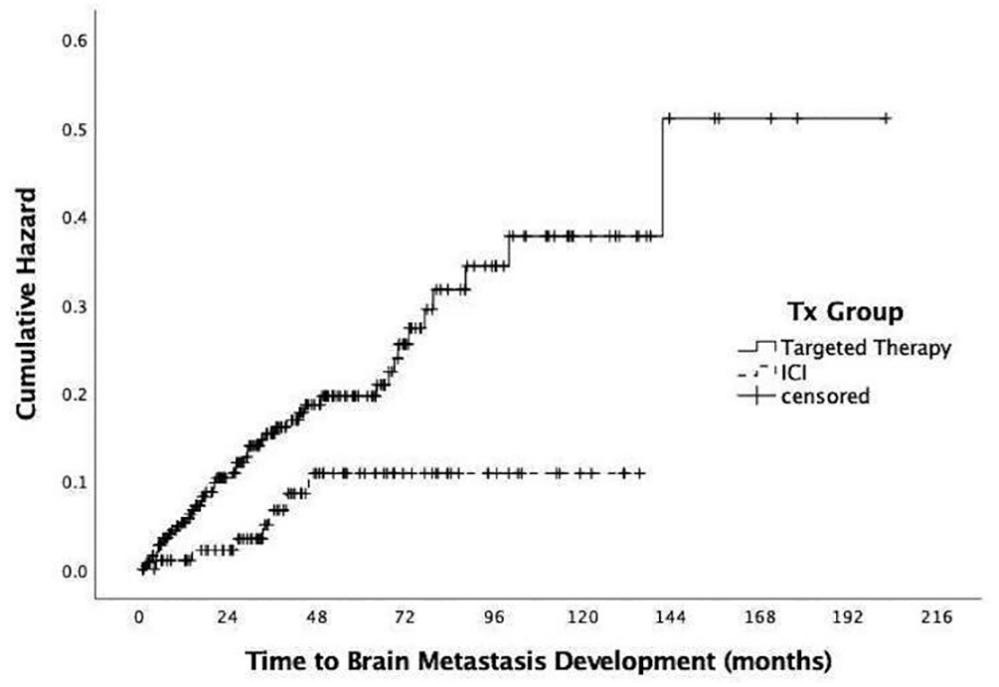
图3. BM发展风险比。在累及颅内前接受治疗的患者中,比较治疗组间脑转移发生风险,并以危险函数曲线显示。失随或未发生脑转移的患者从分析中删除,并在曲线上打勾表示。
研究结论
作者指出,ICI显著改善了RCC脑转移患者的生存率,并相较于靶向治疗降低了转移性RCC患者发生脑转移的可能性。然而,尽管在黑色素瘤和非小细胞肺癌BMs中,ICI的应用被认为优先于积极的局部治疗,但在RCC BMs中还不能得出这样的结论。进一步研究ICI在手术和放射外科干预中的关系,对于改善RCC BMs患者的预后至关重要。


近期评论