本文是我在2018年发表于《Translational Oncology》的综述文章,我认为融合基因指导的精准靶向治疗,将为恶性胶质瘤带来新的曙光。
https://doi.org/10.1016/j.tranon.2018.02.020
背景介绍:
基因融合是指两个或多个基因的编码区首尾相连,并在同一个转录调控元件内,构成嵌合基因。它们是由基因组重排(例如易位,缺失,重复或倒位)引起的特征性突变。基因组学和转录组学的分析描绘了胶质瘤的分子图谱,发现一部分患者携带有基因融合,并可能作为治疗靶点。作者综述了各种类型胶质瘤中融合基因及靶向治疗的研究进展。
恶性胶质瘤中已报道的基因融合
胶质母细胞瘤(GBM)
GBM是一种预后极差的胶质瘤亚型,基因组学数据显示,基因融合突变在GBM中属于高频事件,约30%-50%的GBM患者样本中具有基因融合,其中最常见的有促癌作用的基因融合是:FGFR融合、EGFR融合、NTRK融合和MET融合。
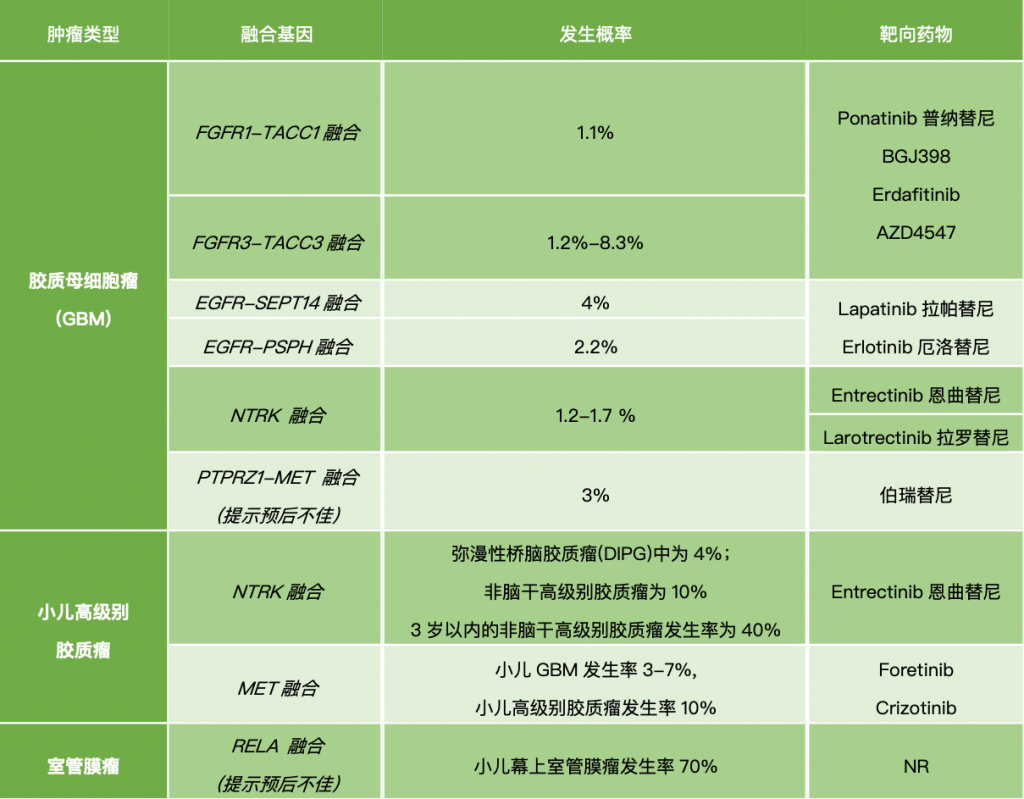
成纤维细胞生长因子受体(FGFR)融合:
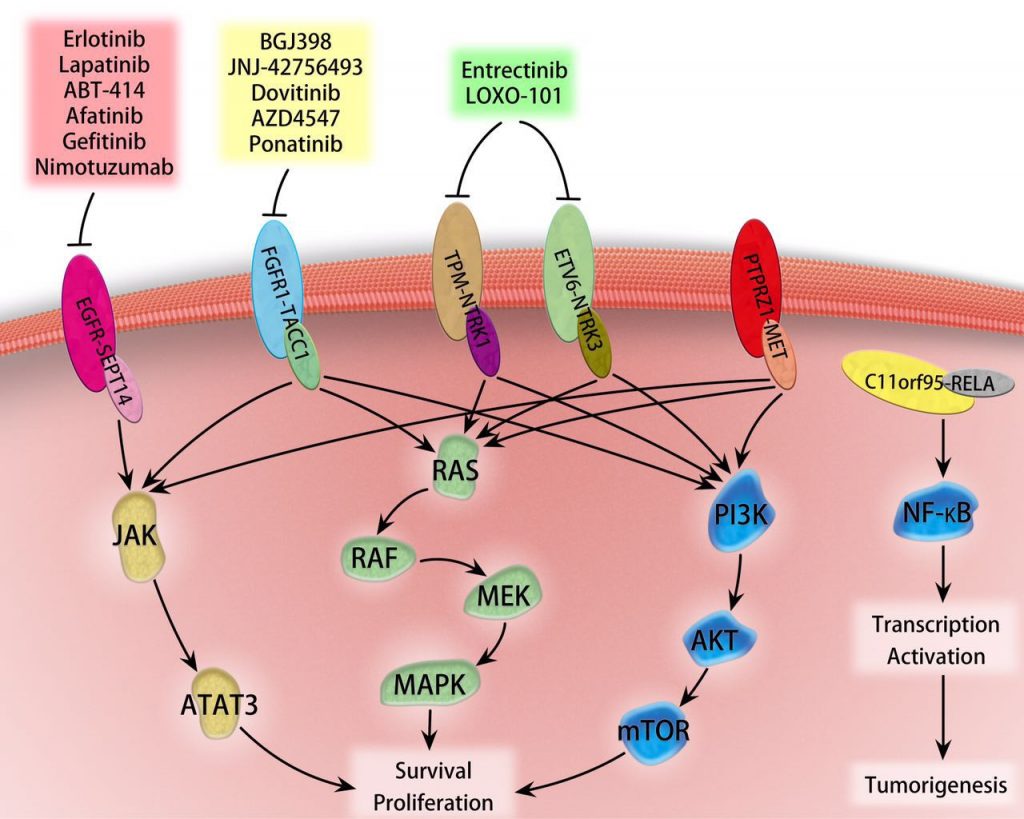
FGFR可与TACC基因形成FGFR-TACC融合。研究表明FGFR3-TACC3融合蛋白促进肿瘤发生和增强肿瘤进展的致癌活性。FGFR3-TACC3的异常表达通常能激活下游MAPK-ERK、PI3K和STAT3信号通路(图2)。
靶向FGFR-TACC融合基因的药物在临床前研究和早期试验都是令人鼓舞的。靶向药物普纳替尼(ponatinib) 治疗复发性GBM的II期临床试验(NCT02478168)正在进行中。Erdafitinib(JNJ-42756493)在一项I期临床实验中用于治疗两名携带有FGFR3-TACC3的GBM患者显示出明显的抗肿瘤活性。BGJ398是一种FGFR1-3激酶抑制剂,在II期临床研究(NCT01975701)中用于评估治疗携带有FGFR-TACC融合和/或FGFR突变的复发性GBM效益。此外,还有一些新的靶向药物正处于临床招募阶段,如AZD4547等。
表皮生长因子受体(EGFR)融合:
EGFR是一个跨膜蛋白,作为表皮生长因子家族的受体。在GBM中EGFR是除FGFR外发生融合概率最高的基因。EGFR常与SEPT14基因发生EGFR-SEPT14融合,在GBM发生的频率是4%,该融合突变能激活STAT3信号通路,从而促进肿瘤增殖和迁移。
临床前的研究表明TKIs,例如拉帕替尼和厄洛替尼能很好的靶向EGFR-SEPT14融合突变而显示出减缓肿瘤生长的良好效果。未来的研究将集中在只携带有EGFR融合突变的患者人群中进行个性化的药物评估。
神经营养型酪氨酸激酶受体(NTRK)融合:
NTRK是神经营养因子受体酪氨酸激酶。该基因的融合使其编码的蛋白处于持续激活状态,驱动肿瘤的扩散和生长。NTRK1常见于许多人类癌症中,但在成人GBMs发生融合突变频率很低,仅为1.2-1.7%。在小儿肿瘤中,4%的弥漫性桥脑胶质瘤(DIPGs)和10%的非脑干的高级别胶质瘤出现NTRK融合,值得强调的是,3岁以内婴儿中40%的非脑干高级别胶质瘤携带有NTRK融合。由此可见,NTRK融合可能在婴儿pHGG中起重要的致瘤驱动因子的作用。
目前,针对TRK抑制剂药物有两款,第一款是Loxo Oncology公司的拉罗替尼Larotrectinib (LOXO-101),2018年11月27日在美国FDA获批上市,用于治疗具有NTRK融合的局部晚期或转移性实体瘤患者,该药物于2019年1月7日被礼来公司收购。第二款是罗氏公司的恩曲替尼Entrectinib (RXDX-101),2019年6月18日在日本上市,用于治疗具有NTRK融合的复发性和晚期实体瘤患者。值得一提的是,这两款药物都是不限年龄、癌肿、只需携带NTRK基因融合的广谱靶向药物。
在一项临床研究(NCT02568267)中,一名携带BCAN-NTRK1融合的桥脑星形细胞瘤患者,使用Entrectinib后,肿瘤体积缩小了45%。另一项临床研究(NCT02576431)则发现:一名35岁,颅内多发GBM的女性患者,检测出EML4-NTRK3融合,给予Larotrectinib治疗后,脑室旁的肿瘤体积显著减小(从67x52mm到8x4mm)。
肝细胞生长因子受体(MET)融合:
MET 基因编码c-MET 蛋白,它是一种肝细胞生长因子受体,具有酪氨酸激酶活性。c-MET的激活与其下游PI3K-AKT-mTOR 通路和RAS-RAF-MEK-ERK 通路的激活密切相关, 从而参与细胞信息传导、细胞骨架重排的调控, 是细胞增殖、分化和运动的重要因素。
在一项基于中国胶质瘤基因组图谱数据库的研究中,在3%(3/99)的GBM患者中发现了一种新的PTPRZ1-MET融合体,这种融合可诱导MET癌蛋白的升高表达和磷酸化,并与预后不良有关。另一项研究中,中国科学家在继发性胶质母细胞瘤(sGBM)患者中鉴定到METex14突变高达14%,而PTPRZ1-MET融合突变频率为4%。MET抑制剂PLB-1001不仅能通过血脑屏障,还对携带有PTPRZ1-MET融合的小鼠模型和胶质瘤患者有效。用于治疗具有ZM融合阳性的sGBM药物伯瑞替尼正处于II期临床招募中。
室管膜瘤
室管膜瘤占恶性原发性中枢神经系统肿瘤的3.6%。室管膜瘤具有多样的预后,可能是因为其在基因组、转录组或者DNA拷贝数等遗传水平上拥有不同的生物学分子特点。目前室管膜瘤根据肿瘤部位和分子特点,可分为9种亚型的分子分型,有助于其制定治疗策略和进行预后评估。基因融合在室管膜瘤中应用于区分2种亚型的分子分型。
RELA融合:
RELA融合突变会导致肿瘤信号通路异常激活。出现RELA融合的室管膜瘤通常被认为是高风险的肿瘤亚型,10年总生存率约为50%,10年无进展生存率约为20%。
YAP1融合:
在发现RELA融合的同一项研究中还鉴定了YAP1融合; 它被认为是幕上室管膜瘤的另一个亚组特征。YAP1融合主要见于中位年龄为1.4岁的室管膜瘤患者,预后相对较好,5年无进展生存率为66%,总生存率为100%。YAP1融合导致室管膜瘤良好预后的详细机制目前尚不清楚。
基因融合的方式和相应的检测技术:
基因融合是两个或多个基因,形成涉及每个基因部分的嵌合基因的过程。不同细胞中融合基因的形成可以通过不同的机制发生。四种染色体重排将导致基因的融合(图1):位于同一条链上的两个基因之间的基因组区域缺失,并通过缺失片段产生融合基因;基因组区域在染色体上重复一次或多次的串联重复;染色体易位,不同染色体上的基因组区域的易位;位于染色体相对链上的两个基因发生倒位而发生基因融合。
随着检测技术的发展,基因测序,尤其是深度测序技术(NGS)提供了一种全新的方法来鉴定基因组DNA或转录组RNA中新的或已知的融合。该技术包括全基因组测序(WGS)、全外显子组测序(WES)和转录组测序(RNA-Seq)。WGS和RNA-Seq是该领域中最常用的NGS检测,它们可以检测由融合引起的多种可变剪接体并着重于基因组的表达区域,这使得检测到的融合基因更具有生物学意义。
总结:
本文总结了成人和小儿恶性胶质瘤中常见且重要的基因融合突变及靶向治疗进展。随着基因检测技术的不断发展和应用,人们对胶质瘤融合突变的理解将更加深入,这将极大的推动胶质瘤的靶向治疗。


近期评论