我的个人解读:
1. 高质量,高通量的基因测序,是一切精准靶向治疗的基石。
2. 泰瑞沙这玩意儿,真是个好东西,如果不考虑价格因素的话。
3. 对于存在EGFR C628F和A289V两个突变位点的患者,如果盲试泰瑞沙,至少有50%的概率,可以达到如图中患者那个额叶病灶的效果。
4. 单用泰瑞沙可能不够,因为肿瘤的异质性很高,无论是抗血管生成(贝伐/安罗/阿帕)还是靶向EGFR的治疗,都应当和细胞毒药物(包括但不限于TMZ、铂类、CPT-11)等连用。
5. EGFRvIII突变阳性有可能对奥西替尼无效,但需要进一步证实。
奥西替尼(泰瑞沙)是口服的第三代酪氨酸激酶抑制剂(TKI),是专门针对EGFR突变的非小细胞肺癌(NSCLC)的EGFR T790M耐药突变而开发的。目前已获得美国FDA的批准,用于一线治疗具有EGFR外显子19缺失或外显子21 L858R突变的转移性NSCLC,以及在先前的EGFR TKI治疗进展后转移性EGFR T790M突变阳性的NSCLC。奥西替尼透过血脑屏障能力强,已有研究证明:对EGFR突变的NSCLC脑转移具有显着疗效。本文中,研究者报告了奥西替尼治疗EGFR突变的GBM患者的疗效。
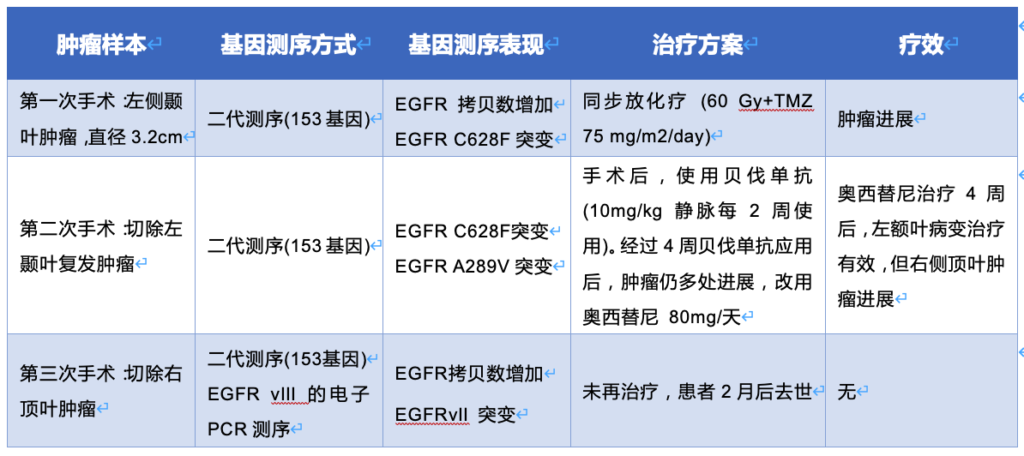
患者是一名既往健康的年轻女子,因为头痛和性格改变进行头颅磁共振检查,发现左颞叶直径约3.2厘米的占位。她接受了手术,肿瘤完整切除。术后组织病理学证实为胶质母细胞瘤(GBM),MGMT启动子未甲基化。患者在宾夕法尼亚大学接受了包含153个基因的靶点的二代测序(NGS), NGS揭示该肿瘤为IDH野生型,并具有EGFR拷贝数增加和EGFR C628F点突变。还进行了融合基因转录组检测,发现EGFRvIII阴性。她接受了同步放化疗(放疗剂量为60 Gy,替莫唑胺每天75 mg/m2)。她的术后MRI显示左侧颞叶手术区域显著增强,并伴有明显的血管性水肿,应用地塞米松也无法缓解,因此接受再次开颅手术。组织病理学证实:切除的组织中主要是治疗相关性改变,少部分是复发/残留GBM病灶。 再次行NGS,发现:EGFR C628F突变(与上次手术相同),以及EGFR A289V突变(新发突变)。RNA融合转录组检查再次提示:EGFRvIII阴性。手术后,患者寻求非传统疗法,失去随访。
她在5个月后返回,当时MRI显示远离原发性手术腔的多灶性双侧肿瘤进展,包括右顶叶病变和左额叶中线旁病变。她开始使用每两周静脉注射贝伐单抗10 mg/kg。尽管两个周期后临床改善不大,复查MRI显示右顶叶和左额叶肿瘤均持续发展(图1A)。
根据患者的基因测序结果,她接受了奥西替尼每天80 mg的治疗,经过1个月的不间断治疗后,MRI扫描显示左前矢状旁额叶肿块几乎完全消散(图1B)。然而,与之对应的是:右顶叶病变继续发展。
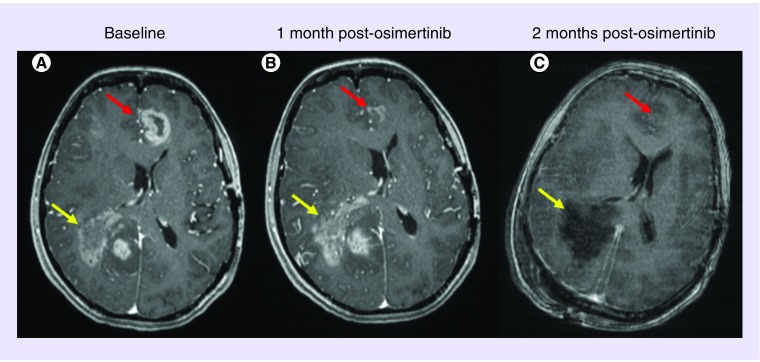
两周后,她接受了第三次开颅手术,切除右顶叶肿瘤。此时,左额叶肿瘤的疗效仍然稳定(图1C)。不幸的是,患者状态持续走低,并在2个月后死亡。最后切除的组织病理学显示GBM复发/残留。NGS揭示,该肿瘤对EGFR点突变阴性,但继续存在EGFR拷贝数增加。临床RNA融合转录产物组检查再次提示:EGFRvIII阴性。但是,在手术之前,患者已签署研究组织库的同意书(宾夕法尼亚大学机构审查委员会协议816686)。通过数字聚合酶链反应PCR,免疫组织化学和RNA-Seq对标本进行的进一步分析显示EGFRvIII阳性。
这是首次报道使用奥西替尼治疗GBM的病例。患者肿瘤样本的基因检测发现了两个EGFR点突变(C628F和A289V),虽然尚无临床前或临床数据表明这些突变对TKI治疗敏感,但试验性的应用奥西替尼,其中一个肿瘤近乎消散。由于左额叶这个区域不在放疗范围内,因此可以排除假性进展。另一肿瘤在奥西替尼上继续进展。切除该肿瘤,发现EGFR点突变阴性,而EGFRvIII阳性。
回顾既往研究,尽管GBM中出现EGFR突变的相当多,但在GBM中靶向EGFR的临床研究结果却令人失望。首要原因是现有的EGFR抑制剂的穿透血脑屏障的能力不足。另一个原因是:通常在GBM中检测到的EGFR突变位点,和临床常用的EGFR小分子抑制剂的靶点并不匹配。
该患者在不同的时间点切除了三个单独的肿瘤,基因测序提示:第一个肿瘤中有EGFR C628F突变,第二个肿瘤中有EGFR C628F和A289V突变,第三个肿瘤中仅有EGFRvIII突变。此外,仅当通过多种不同方法测试肿瘤的EGFRvIII时,才在第三肿瘤中检测到EGFRvIII。由于在前两次测序中检测EGFRvIII的方法不同,因此还不能判断,在前两个肿瘤中,是否真的不存在EGFRvIII突变。
作者认为:该研究为EGFR突变的GBM患者带来了一线曙光,未来需要进行进一步的研究来明确,究竟出现怎样突变的EGFR是最适合使用泰瑞沙进行治疗的患者。
原文链接:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6880297/
本文译稿同步发表于《神外资讯》,链接:



近期评论